در سال 1964، دانشمندان موسسه تحقیقات هسته ای جوینتدر دوبنا (روسیه) پلوتونیم را با یونهای شتابدار شده 113 تا 115 MeV نئون بمباران کردند. با اندازه گیری باریکه های شکافتی در شیشه با میکروسکوپ، ایزوتوپی را ردیابی کردند که با شکافت خود به خود تجزیه شد. آنها بیان کردند که این ایزوتوپ با نیمه عمر 0.3 +/- 0.1 ثانیه، 260-104 است که در اثر واکنش زیر تولید شده است:
242Pu + 22Ne --> 260Rf +4n.
عنصر 104، نخستین عنصر ترانس آکتینید است و احتمالا ویژگیهای شیمیایی آن مشابه هافنیم است. مثلا با کلرین ترکیب نسبتا فراری را تشکیل می دهد (تتراکلرید).
دانشمندان روسی به منظور شناسایی شیمیایی این عنصر، آزمایشهایی را انجام دادند و تلاش کردند نشان دهند که فعالیت 0.3 ثانیه ای آن فعالتر از تری کلریدهای آکتینید غیر فراراست. دراین آزمایش، آزمایش جدایش شیمیایی عنصر جدید از بقیه عناصرکامل نشد اما شواهد مهمی به دست نیامد. داده های منتشر شده توسط دانشمندان روسی نیمه عمر ایزوتوپی را که آنها با آن کار می کردند، از 0.3 ثانیه به 0.15 ثانیه کاهش داد.
در سال 1969، گیورسو، نورمیا، هریس، اسکولا و اسکولا از دانشگاه کالیفرنیا در برکلی، گزارش کرد که آنها دو یا سه ایزوتوپ عنصر 104 را کشف کرده اند. این گروه نشان داد که بعد از تلاشهای گزارش شده آنها ایزوتوپ 260104 را که در سال 1964 توسط گروه دابنا گزارش شده را تولید کرده اند.
این اکتشاف برکلی، با بمباران عنصرکالیفرنیم 249 با هسته های کربن 12 و 71 MeV و هسته های کربن 13 و 69 MeV انجام شد. با ترکیب کربن 12 با کالیفرنیم 249، تابش آنی چهار نوترون، عنصر257104 را تولید کرد. این ایزوتوپ نیمه عمر 4 تا 5 ثانیه را داشت که با ساطع کردن ذرات آلفا به نوبلیم 253 تبدیل شد که نیمه عمر 105 ثانیه داشت.
احتمالا با تابش سه نوترون واکنش مشابهی رخ می دهد و 258104 را با نیمه عمر 100/1 ثانیه تولید کرد.
عنصر 259104، از ترکیب هسته های کربن 13 با کالیفرنیم 249، و با تابش سه نوترون تشکیل شد. این ایزوتوپ نیمه عمر 3 تا 4 ثانیه داشت و با تابش ذرات آلفا به نوبلیم 255 تبدیل تجزیه شد که نیمه عمر 185 ثانیه داشت.
هزاران اتم 257104 و 259104 آشکارسازی شده است. گروه برکلی معتقدند که شناسایی 258-104 توسط آنها صحیح است اما در این مورد نسبت به کاری که روی 257104 و 259104 انجام شد، اطمینان کمتری وجود دارد.

عنصر Rf در طبیعت
اثرات رادرفوردیم بر روی سلامتی
رادرفوردیم آن قدر ناپایدار است که هر مقداری از آن تشکیل شود، به سرعت به عناصر دیگر تبدیل می شود. بنابراین لزومی ندارد که اثرات و خطرات آن را بر روی سلامتی بررسی کنیم.
اثرات زیست محیطی رادرفوردیم
به علت نیمه عمرکوتاه رادرفوردیم (حدود 10 دقیقه)، لزومی ندارد که اثرات آن را بر روی محیط زیست بررسی کنیم.
خواص فیزیکی و شیمیایی عنصر رادرفوردیم :
عدد اتمی:104
جرم اتمی:261
حالت استاندارد: جامد
رنگ: سفید نقره ای
نام گروه:فلز واسطه 4
دوره تناوبی :7
شکل الکترونی: [Rn]7s25f146d 2
شماره سطح انرژی : 7
اولین انرژی : 2
دومین انرژی : 8
سومین انرژی : 18
چهارمین انرژی : 32
پنجمین انرژی : 32
ششمین انرژی : 10
هفتمین انرژی : 2
ایزوتوپ :
ایزوتوپ نیمه عمر
Rf-257 4.7 ثانیه
منبع : معرفی عناصر - P30World Forums
|
|||||||||||||||||||||||||
| عمومی | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| نام , علامت اختصاری , شماره | Iodine, I, 53 | ||||||||||||||||||||||||
| گروه شیمیایی | هالوژنها | ||||||||||||||||||||||||
| گروه , تناوب , بلوک | p , 5 , 17VIIA | ||||||||||||||||||||||||
| جرم حجمی , سختی | 4940 kg/m3 , نامشخص | ||||||||||||||||||||||||
| رنگ | خاکستری تیره مایل به بنفش درخشان  |
||||||||||||||||||||||||
| خواص اتمی | |||||||||||||||||||||||||
| وزن اتمی | 126.90447 amu | ||||||||||||||||||||||||
| شعاع اتمی (calc.) | 140 (115) pm | ||||||||||||||||||||||||
| شعاع کووالانسی | 133 pm | ||||||||||||||||||||||||
| شعاع وندروالس | 198 pm | ||||||||||||||||||||||||
| ساختار الکترونی | krypton]4 d10 5 s2 5p5] | ||||||||||||||||||||||||
| -e بازای هر سطح انرژی | 2, 8, 18, 18, 7 | ||||||||||||||||||||||||
| درجه اکسیداسیون (اکسید) | ±1,5,7 (اسید قوی) | ||||||||||||||||||||||||
| ساختار کریستالی | اورتورومبیک | ||||||||||||||||||||||||
| خواص فیزیکی | |||||||||||||||||||||||||
| حالت ماده | جامد (غیر مغناطیس) | ||||||||||||||||||||||||
| نقطه ذوب | 386.85 K (236.66 °F) | ||||||||||||||||||||||||
| نقطه جوش | 457.4 K (363.7 °F) | ||||||||||||||||||||||||
| حجم مولی | 25.72 scientific notationש10-6 m3/mol | ||||||||||||||||||||||||
| گرمای تبخیر | 20.752 kJ/mol | ||||||||||||||||||||||||
| گرمای همجوشی | 7.824 kJ/mol | ||||||||||||||||||||||||
| فشار بخار | Pa at K | ||||||||||||||||||||||||
| سرعت صوت | m/s at K | ||||||||||||||||||||||||
| متفرقه | |||||||||||||||||||||||||
| الکترونگاتیویته | 2.66 (درجه پاولینگ) | ||||||||||||||||||||||||
| ظرفیت گرمایی ویژه | 145 J/kg*K | ||||||||||||||||||||||||
| رسانائی الکتریکی | 8.0 10-8/m اهم | ||||||||||||||||||||||||
| رسانائی گرمایی | 0.449 W/m*K | ||||||||||||||||||||||||
| 1st پتانسیل یونیزاسیون | 1008.4 kJ/mol | ||||||||||||||||||||||||
| 2nd پتانسیل یونیزاسیون | 1845.9 kJ/mol | ||||||||||||||||||||||||
| 3rd پتانسیل یونیزاسیون | 3180 kJ/mol | ||||||||||||||||||||||||
| پایدارترین ایزوتوپها | |||||||||||||||||||||||||
|
|||||||||||||||||||||||||
| واحدهای SI & STP استفاده شده ، مگر آنکه ذکر شده باشد. | |||||||||||||||||||||||||
اطلاعات اولیه
ید ، عنصر شیمیایی است که در جدول تناوبی دارای نشان I و عدد اتمی 53 می باشد. عنصری است حل نشدنی که مقدار بسیار کم آن برای موجودات زنده لازم است. واکنش پذیری ید از تمامی هالوژنها کمتراست و الکترون دهنده ترین هالوژن شبه فلز می باشد. از ید عمدتا" در پزشکی ، عکاسی و رنگ استفاده میشود.تاریخچــــه
ید ( واژه یونانِ iodes به معنی بنفش) در سال 1811 توسط Barnard Courtois کشف شد.پیدایــــش
ید بسیار خالص را می توان از واکنش یدید پتاسیم با سولفات مس تهیه کرد.البته روشهای دیگری نیز برای جداسازی این عنصر وجود دارد.خصوصیات قابل توجه
ید عنصر جامد درخشانی است به رنگ آبی مایل به سیاه که در دماهای استاندارد به بخاری بنفش رنگ و بد بو تبدیل می گردد.این هالوژن همچنین با بسیاری از عناصر، ترکیباتی را می سازد اما از سایر عناصر گروه هالوژنها فعالیت کمتری داشته و دارای خصوصیاتی شبیه فلزات است.ید به راحتی در کلروفرم، تتراکلرید کربن یا دی سولفید کربن حل شده و محلولهای ارغوانی رنگی بوجود می آورد( تنها به مقدار کمی در آب قابل حل است) .رنگ آبی سیر با محلول نشاسته ویژگی ید آزاد می باشد.کاربردهــــــا
در مناطقی که غذای آنها حاوی مقدار کم ید می باشد – مثلا" مناطق دور افتاده از دریا که هیچگونه غذای دریایی مصرف نمی شود- کمبود ید ابتلا به بیماری گواتر اصطلاحا" گواتر محلی را افزایش می دهد.در بیشتر ( نه تمامی) این مناطق با افزودن مقدار کم یدید سدیم به نمک طعام از ابتلا به این بیماری جلوگیری شده است.این محصول به نام نمک ید دار نیز معروف است.کاربردهای دیگر این عنصر:- یکی از هالوژنها است که وجود آن به مقدار کم برای موجودات زنده حیاتی است ؛ هورمون تیروئید تیروکسین و تری یدوتیرونین حاوی اتمهای ید می باشد.
- تنتور ید ( 3% ید عنصری در پایه آب / اتانول) از اجزاء مهم تمامی وسایل کمکهای اولیه می باشد که هم برای ضد عفونی کردن زخمها و هم برای پاکسازی آبهای شرب سطحی مورد استفاده قرار می گیرد( 3 قطره در هر لیتر ، پس از 30 دقیقه تاثیر می کند).
- ترکیبات ید در رشته شیمی آلی مهم و در پزشکی بسیار سودمند هستند.
- از یدیدها و تیروکسین که حاوی ید هستند در پزشکی داخلی و در ترکیب با الکل ( بعنوان تنتور ید) برای ضد عفونی نمودن زخمهای بیرونی استفاده می شود.
- یدید پتاسیم در عکاسی کاربرد دارد.
- یدید تنگستن برای تقویت افروزه لامپها مورد استفاده قرار می گیرد.
- تری یدید نیتروژن برای کاربردهای تجاری بسیار انفجاری و ناپایدار است اما جزو شوخیهای معمول دانشگاهی به حساب می آید.
ایزوتوپهـــــــا
برای ید 30 ایزوتوپ وجود دارد که تنها یکی از آنها I-127 پایدار است.از ایزوتوپ رادیواکتیو مصنوعی I-131 ( ساطع کننده بتا) که دارای نیمه عمر 8 روز است برای درمان سرطان و دیگر بیماریهای غده تیروئید استفاده می گردد.معمول ترین ترکیبات ید عبارتند از یدیدهای سدیم و پتاسیم ( KI) و یدیتها ( KIO3).ید فقط یک ایزوتوپ پایدار I-127 دارد.با این همه ایزوتوپهای رادیواکتیو ید کاربردهای وسیعی دارند.I-129 با نیمه عمر 17 میلیون سال محصولی از پراش Xe-129 در اتمسفر است اما نتیجه فروپاشی U-238 نیز می باشد.چون U-238در خلال فعالیتهای مربوط به انرژی هسته ای تولید می شود، وجود آن ( به نسبت I-129/I) می تواند فعالیتهای در حال انجام در هر مکان را مشخص کند.به همین علت از I-129 در مطالعات آب باران بعد از حادثه چرنوبیل استفاده شد.از آن همچنین بعنوان ردیاب آبهای زیر زمینی و نشان دهنده پراکندگی فضولات در محیط زیست استفاده می گردد.سایر کاربردها ممکن است بوسیله تولید I-129 در پوسته زمین ازطریق تعدادی مکانیسم فروپاشی مختل شود.
I-129 از جهات زیادی شبیه Cl-36|chlorine است. این ایزوتوپ ، هالوژنی قابل حل و نسبتا" واکنش ناپذیر است که بیشتر بصورت آنیونی non-sorbing یافت شده و بوسیله واکنشهای کیهانزاد ، حرارت اتمی و ثابت تولید می شود. درمطالعات آب شناسی چگاله های I-129 معمولا" به نسبت I-129 به مقدار کلی I گزارش می شود( که عملا" I-127 است).چون نسبتهـــــــــای Cl-36/Cl,I-129/I در طبیعت تقریبا" کم می باشد ( 14-10تا 10-10) اوج حرارت اتمی I-129/I در طول دهه 70 و 80 تقریبا" به 7-10رسید.I-129 با Cl-36 در بعضی موارد فرق دارد ؛ نیمه عمر آن طولانی تر است ( vs6/1 ، 3/0 میلیون سال)، به شدت biophilic است و به اشکال یونی چندگانه وجود دارد ( معمولا" I- و یودیت) که دارای رفتار شیمیایی متفاوتی هستند.
هشدارهـــــــــا
تماس مستقیم آن با پوست ممکن است آسیبهایی را به همراه داشته باشد پس هنگام کار با ید باید بسیار احتیاط نمود.بخار ید باعث دردناک شدن چشم و غشاء مخاطی می شود.حداکثر مقدار مجاز ید در هوا نباید از 1 میلی گرمدر هر متر مکعب فراتر رود.
|
|||||||||||||||||||||||||||||||||||||
| عمومی | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| نام, علامت اختصاری, شماره | Cobalt, Co, 27 | ||||||||||||||||||||||||||||||||||||
| گروه شیمیایی | فلز انتقالی | ||||||||||||||||||||||||||||||||||||
| گروه, تناوب, بلوک | 9 , 4 , d | ||||||||||||||||||||||||||||||||||||
| جرم حجمی, سختی | 8900 kg/m3, 5.0 | ||||||||||||||||||||||||||||||||||||
| رنگ | فلزی با ته مایه خاکستری |
||||||||||||||||||||||||||||||||||||
| خواص اتمی | |||||||||||||||||||||||||||||||||||||
| وزن اتمی | 1 E-_ kg | ||||||||||||||||||||||||||||||||||||
| شعاع اتمی calc. | 1 E-_ m | ||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | 126 pm | ||||||||||||||||||||||||||||||||||||
| شعاع واندروالس | n/a pm | ||||||||||||||||||||||||||||||||||||
| ساختار الکترونی | Ar]3d74s2] | ||||||||||||||||||||||||||||||||||||
| -e بازای هر سطح انرژی | 2, 8, 15, 2 | ||||||||||||||||||||||||||||||||||||
| درجه اکسیداسیون (اکسید) | 2,3 (آمفوتریک) | ||||||||||||||||||||||||||||||||||||
| ساختار کریستالی | شش گوش | ||||||||||||||||||||||||||||||||||||
| خواص فیزیکی | |||||||||||||||||||||||||||||||||||||
| حالت ماده | جامد (فرومغناطیس) | ||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 1768 K (2723 °F) | ||||||||||||||||||||||||||||||||||||
| نقطه جوش | 3200 K (5301 °F) | ||||||||||||||||||||||||||||||||||||
| حجم مولی | 6.67 ((scientific notation|ש»10-6 m3/mol | ||||||||||||||||||||||||||||||||||||
| گرمای تبخیر | 376.5 kJ/mol | ||||||||||||||||||||||||||||||||||||
| گرمای هم جوشی | 16.19 kJ/mol | ||||||||||||||||||||||||||||||||||||
| فشار بخار | 175 Pa at 1768 K | ||||||||||||||||||||||||||||||||||||
| سرعت صوت | 4720 m/s at 293.15 K | ||||||||||||||||||||||||||||||||||||
| متفرقه | |||||||||||||||||||||||||||||||||||||
| الکترونگاتیویته | 1.88 (درجه پائولینگ) | ||||||||||||||||||||||||||||||||||||
| ظرفیت گرمایی ویژه | 420 J/kg*K | ||||||||||||||||||||||||||||||||||||
| رسانائی الکتریکی | 17.2 106/m اهم | ||||||||||||||||||||||||||||||||||||
| رسانائی گرمایی | 100 W/m*K | ||||||||||||||||||||||||||||||||||||
| 1st پتانسیل یونیزاسیون | 760.4 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2nd پتانسیل یونیزاسیو.ن | 1648 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 3rd پتانسیل یونیزاسیون | 3232 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 4th پتانسیل یونیزاسیون | 4950 kJ/mol | ||||||||||||||||||||||||||||||||||||
| پایدارترین ایزوتوپها | |||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
| واحدهای SI & STP استفاده شده ، مگر آنکه ذکر شده باشد. | |||||||||||||||||||||||||||||||||||||
اطلاعات اولیه
کبالت ، عنصر شیمیایی است که با نشان Co و عدد اتمی 27 در جدول تناوبی قرار دارد.تاریخچه
کبالت و ترکیبات آن در دوران باستان شناخته شد که برای آبی کردن رنگ شیشه از آنها استفاده میکردند. "George Brand" به خاطر کشف کبالت شهرت یافت. تاریخ کشف این عنصر در منابع مختلف ، متفاوت است، اما این کشف بین سالهای 1730 و 1737 اتفاق افتاده است. او موفق به اثبات این نکته شد که منبع رنگ آبی شیشهها کبالت است. قبلا" بیسموت همراه کبالت را عامل رنگ آبی شیشهها میدانستند.در خلال قرن نوزدهم ، کبالت آبی (80 -70% کبالت جهان ) در Blaafarvaerket در نروژ ، به رهبری صنعتگر پروسی "Benjamin Wegner" تولید شد. "John Livingood" و "Glenn Seaborg" در سال 1938 کبالت 60 را کشف کردند. کلمه کبالت از واژه آلمانی kobalt یا kobold ، به معنی روح شیطان گرفته شده است. این نام را کارگران معدن بهعلت سمی و دردسرساز بودن این عنصر برای آن انتخاب کردند. ( کبالت سایر عناصر معدن را آلوده و کم عیار میکرد. )
پیدایش
کبالت ، بصورت فلز آزاد وجود ندارد و عموما" بهصورت سنگ معدن یافت میشود. کبالت معمولا" بهتنهایی استخراج نمیشود و بهعنوان محصول جانبی فعالیتهای استخراج مس و نیکل بدست میآید. |
سنگ معدنهای اصلی کبالت عبارتند از: کبالتیت ، اریتریت ، گلائوکودوت و اسکوترودیت. عمدهترین تولید کنندگان کبالت در جهان ، چین ، زامبیا ، روسیه و استرالیا هستند.
ترکیبات
بهعلت وجود حالتهای اکسیداسیون مختلف ، تعداد زیادی از ترکیبات کبالت وجود دارد. هر دو اکسید در دمای پایین ، ضدفرومغناطیس میباشند؛ CaO ، Co3O4 .خصوصیات قابل توجه
کبالت ، عنصر فرومغناطیس سختی است که دارای رنگ خاکستری براقی میباشد.دمای کوری آن ، K1388 با ممنتم بور 6/1 – 7/1 در هر اتم است. این عنصر اغلب با نیکل همراه است و هر دوی آنها از اجزای مشخص فلز شهاب سنگی میباشند. پستانداران ، نیازمند مقدار بسیار کمی از نمکهای کبالت هستند. کبالت 60 که ایزوتوپ رادیواکتیو و مصنوعی کبالت است، یک ردیاب رادیواکتیو مهم و عامل معالج سرطان بهشمار میآید. نفوذ پذیری نسبی کبالت ، دو سوم آهن است. کبالت ، فلزی عموما" دارای مخلوطی از دو ساختار شکل بلورین fcc و hcp با دمای انتقال fcc --> hcp K722 میباشد. حالات اکسیداسیون عادی کبالت ، شامل 2+ و3+ است، گرچه 1+ نیز دیده شده است.کاربردها
- آلیاژهایی از قبیل :
- آلیاژهای دیرگداز ، برای قطعات توربین گاز موتورهای هواپیما.
- آلیاژهای مقاوم در مقابل فرسایش و آسیب بر اثر کارکرد بالا.
- فولاد ، در سرعتهای بسیار زیاد.
- کاربیدهای روکشدار ( فلزات سخت هم نامیده میشوند ) و ابزارهای الماسه.
- آهن ربا و واسطه ضبط مغناطیسی ( ازقبیل نوار کاست و ویدئو ).
- کاتالیزور برای مصرف در صنایع شیمیایی و نفتی.
- در آبکاری الکتریکی برای ظاهر ، استحکام و مقاوت در برابر اکسیداسیون.
- عامل خشک کننده در رنگها ، جوهر و براقکنندهها.
- لایه زیرین در لعابهای چینی.
- رنگدانه ( کبالت آبی و سبز ).
- الکترودهای باطری.
- تایرهای رادیال تسمه فولادی.
- کبالت –60 بعنوان منبع اشعه گامادارای چندین کاربرد است :
- در پرتو درمانی ( رادیوتراپی ) بکار میرود.
- در استرلیزه کردن غذاها با روش تابشی ( پاستوریزه کردن سرد ) بکار میرود.
- در رادیوگرافی صنعتی بهمنظور تشخیص عیوب ساختاری قطعات فلزات بکار میرود.
کاربردهای پزشکی
کبالت 60 ( Co-60) ، فلزی رادیواکتیو است که در پرتودرمانی کاربرد دارد. کبالت 60 دو اشعه X و گاما با انرژیهای 1.17MeV و 1.33MeV تولید میکند. منبع کبالت 60 تقریبا" به قطر 2 سانتیمتر است که نتیجه آن ، تشکیل یک نیم سایه هندسی است که لبه میدان تشعشع را نامشخص میکند. از ویژگیهای بد این فلز ، تولید مقدار کمی غبار رقیق است که باعث بروز مشکلاتی در حفاظت مقابل اشعه میگردد.منبع کبالت 60 تقریبا" برای 5 سال مفید است، اما بعد از این مدت هم بسیار رادیواکتیو میباشد و بنابراین دستگاههای کبالت در جوامع غربی که لیناکس متداول است، کمتر مورد استفاده قرار میگیرند. اولین دستگاه کبالت 60 درمانی ( بمب کبالت ) برای اولین در کانادا ساخته شد و نیز برای اولین بار در همانجا مورد استفاده قرار گرفت. در واقع اولین دستگاه در مرکز سرطانی Saskatoon به نمایش در آمده است.
نقش بیولوژیک
مقادیر کم کبالت برای بسیاری از موجودات زنده از جمله انسان ، حیاتی است. وجـــــــــــــــــود 0.3 تا 0.13 قسمت در میلیون کبالت در خاک برای سلامتی حیوانات علفخوار مفید است. این عنصر ، جزء اصلی ویتامین کبالامین یا ویتامین B-12 میباشد.ایزوتوپها
کبالت ، بصورت طبیعی دارای 1 ایزوتوپ پایدار ( 59- Co) میباشد.22 رادیوایزوتوپ نیز شناخته شده که پایدارترین آنها Co-60 با نیمه عمر 5,2714 سال ، CO-57 با نیمه عمر 271,79 روز ، Co-56 با نیمه عمر 77,27 روز و Co-58 با نیمه عمر 70,86 روز هستند. مابقی ایزوتوپهای رادیواکتیو ، دارای نیمه عمری کمتر از 18 ساعت هستند که اکثریت آنها نیمه عمری کمتر از 1 ثانیه دارند. این عنصر همچنین دارای 4 حالت برانگیختگی است که تمامی آنها نیمه عمری کمتر از 15 دقیقه دارند.ایزوتوپهای کبالت از نظر وزن اتمی ، بین 50amu و amu 73 قرار دارند. حالت فروپاشی اصلی قبل از فراوانترین ایزوتوپ پایدار 59-Co ، الکترون گیری و حالت اصلی بعد از آن کاهش بتا میباشد.محصول فروپاشی اصلی پیش از 59-Co ایزوتوپهای عنصر 26 (آهن) و محصولات اصلی بعد از آن ایزوتوپهای عنصر 28 (نیکل) میباشند.
هشدارهــــــــــا
فلز کبالت پودر شده ، خطر آتش سوزی به همراه دارد. بهتر است همه ترکیبات کبالت را سمی در نظر گرفت، مگر اینکه خلاف آن ثابـت شده باشد. احتمالا"بیشتر ترکیبات کبالت خیلی زهرآگین نیستند. کبالت 60 ، ارسال کننده اشعه گامای قوی است، لذا تماس با این نوع کبالت خطر ابتلا به سرطان را ایجاد میکند. بلع کبالت 60 منجر به ورود مقداری کبالت درون بافتهای بدن میشود که بهکندی از بدن خارج میشود.کبالت 60 در مقابلههای اتمی ، عاملی خطرساز است، چون ارسالهای نوترونی مقداری از آهن را به این ایزوتوپ رادیواکتیو تبدیل میکند. بعضی طراحیهای تسلیحات اتمی ، عمدا" به گونه ای میباشد که میزان کبالت 60 را که بعنوان ذرات رادیواکتیو پراکنده میشوند، افزایش دهند. گاهی اوقات آنها را بمب کثیف یا بمب کبالت مینامند. خطر در مواقع غیر از جنگ اتمی ، استفاده نادرست ( یا سرقت ) از واحدهای رادیوتراپاتیک پزشکی است.
Hafnium
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
هافنیم عنصر شیمیایی است که در جدول تناوبی دارای نشان Hf و عدد اتمی 72 می باشد.هافنیم که فلزی انتقالی ، خاکستری رنگ ، چهار ظرفیتی و جزو عناصر واسطه است از نظر شیمیایی شبیه زیرکونیم بوده و در کانیهای زیرکونیم یافت می شود. این عنصر در آلیاژهای تنگستن موجود در الکترودها و افروزه های لامپ مورد استفاده قرارگرفته و نیز در میله های کنترل اتمی بعنوان جذب کننده نوترون عمل می کند.
|
|
|
|
|
|
هافنیم فلزی است چکش خوارو به رنگ نقره ای براق که در برابر فرسودگی مقاوم بوده و از نظر شیمیایی مانند زیرکونیم است. ویژگیهای هافنیم بطور چشمگیری تحت تاثیر ناخالصیهای زیرکونیم است و این دو عنصر در زمره مشکل ترین عناصر از نظر تفکیک می باشند.تنها تفاوت قابل توجه بین این دو عنصر ،چگالی آنها است(چگالی زیرکونیم نصف هافنیم می باشد). |
|
به علت توانایی هافنیم در جذب نوترون ،خصوصیات مکانیکی بسیار خوب آن و ویژگی مقاومت استثنایی آن در برابر فرسودگی از این عنصر در ساخت میله های کنترل اتمی نظیر آنچه در زیردریائیهای اتمی وجود دارد استفاده می شود ( واکنش سنجی جذب حرارتی نوترون آن نزدیک به 600 برابر زیرکونیم است). کاربردهای دیگر آن : |
|
هافنیم را ( از واژه لاتین Hafnia برای کپنهاک) Dirk Coster و Georg von Hevesy سال 1923 در کپنهاک دانمارک کشف کردند. کمی بعد از آن با استفاده از نظریه بور احتمال پیوند این عنصر تازه کشف شده با زیرکونیم پیش بینی شد و سرانجام از طریق تحلیل طیف نمای اشعه X در نروژ، هافنیم را در زیرکن کشف نمودند. |
|
هافنیم بصورت ترکیب با ترکیبات طبیعی زیرکونیم یافت می شود اما هرگز به شکل آزاد در طبیعت وجود ندارد. کانیهایی که حاوی زیرکونیم می باشند مانند: alvite ( Hf,Th,ZrSiO4H))2((O) thortveitite و zircon (ZrSiO4) معمولاً دارای 1 و 5 درصد هافنیم هستند.خواص شیمیایی نسبتاً مشابه هافنیم و زیرکونیم باعث مشکل شدن جداسازی این دو عنصر گشته است. تقریباً نیمی از کل فلز هافنیم تولید شده از طریق پالایش یک محصول جانبی زیرکونیم بدست می آید که این کار در فرآیند کرول بوسیله کاهش تتراکلرید هافنیم با منیزیم یا سدیم انجام می شود. |
|
در موقع برش هافنیم باید بسیار دقت کرد چون هنگام تبدیل آن به قطعات کوچک ،آتشگیر است و می تواند خود به خود در مجاورت هوا محترق شود. بیشتر مردم به ندرت با ترکیباتی که دارای این فلز هستند مواجه می شوند و فلز خالص آن عموماً سمی نمی باشد اما با تمامی ترکیبات آن باید به گونه ای رفتار شود که گویی سمی هستند (اگرچه خطر دسترسی افراد به آنها بسیار کم است). |
منبع : http://www.ngdir.ir
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
اطلاعات اولیه
تانتالم ( سابقا" تانتالیم نامیده میشد ) عنصر شیمیایی است که با نشان Ta و عدد اتمی 73 در جدول تناوبی وجود دارد. تانتالم که فلز انتقالی براق ، سخت ، کمیاب و به رنگ آبی خاکستری است، بهشدت در برابر فرسایش بوسیله اسید مقاوم بوده ، در کانی تانتالیت وجود دارد. تانتالم چون با مایعات بدن واکنش نمیکند، در وسایل جراحی و پیوندها بکار میرود.تاریخچــــــــــه
تانتالم ( واژه یونانی Tantalos، ویژگی اسطورهشناسی ) در سال 1802 توسط "Anders Ekeberg" در سوئد کشف شد و در سال 1820، بوسیله "Jons Berzelius" جداسازی شد. بسیاری از شیمیدانان معاصر تا سال 1844 تصور میکردند نیوبیم و تانتالم عناصری مشابه هستند تا اینکه پس از سال 1866 محققان اثبات کردند اسیدهای نیوبیم و تانتالم ترکیباتی متفاوت میباشند.محققان در ابتدا فقط توانستند نوع ناخالص این فلز را جدا کنند و اولین شکل نسبتا" خالص و انعطاف پذیر این فلز در سال 1903 بوسیله "Werner von Bolton" تولید شد. قبل از تنگستن از سیمهای باریک تانتالم در لامپ استفاده میشد.
نام این عنصر از نام تانتالوس ، پدر نایوبی در اسطوره شناسی یونانی گرفته شده که پس از مرگ مجازات شد بصورتیکه با میوه هایی رسیده بالای سرخود محکوم به ایستادن تا زانو در آب بود و هر دو حالت برای همیشه او را به هوس میانداخت؛ اگر برای نوشیدن آب خم شود، سطح آب پایین میرود و اگر برای چیدن میوه اقدام کند شاخهها از دسترس او دور میشوند. این حالت مشابه خصوصیت عمومی واکنشناپذیری تانتالم به حساب میآید. این عنصردر کنار معرفها قرار میگیرد، ولی تحت تاثیر آنها واقع نمیشود.
پیدایـــــــــــش
تانتالم ، اصولا" در کانی تانتالیت و اوکسنیت و سایر کانیها ( سامارسکیت و فرگوسونیت ) یافت میشود. کانیهای تانتالم در استرالیا ، برزیل ، کانادا ، جمهوری دموکراتیک کنگو ، موزامبیک ، نیجریه ، پرتقال و تایلند استخراج میشوند. تانتالیت اکثرا" به همراه کلمبیت در سنگ معدنی به نام کلتان وجود دارد که درباره منابع آنها سوالاتی مطرح شده است.مراحل پیچیده ای برای جداسازی تانتالم از نیوبیم بکار گرفته میشود. برای تولید تجاری این عنصر باید از یکی از روشهای متفاوت این کار استفاده نمود، مثلا" الکترولیز فلوروتنتالات پتاسیم مذاب ، کاهش فلوروتنتالات پتاسیم با سدیم یا بوسیله واکنش کاربید تانتالم با اکسید تانتالم. تانتالم همچنین یک محصول جانبی از استخراج قلع میباشد.
خصوصیات قابل توجه
تانتالم خاکستری رنگ ، سنگین ، انعطاف پذیر ، بسیار سخت ، بهآسانی قابل تهیه ، بهشدت در برابر اسیدها مقاوم و از هدایت الکتریکی و حرارتی خوبی برخوردار میباشد. در واقع این فلز در دماهای زیر 150 درجه سانتیگراد ، کاملا" از حملات شیمیایی مصون است و فقط توسط اسید هیدروفلوئوریک ، محلولهای اسیدی حاوی یون فلورید و تریاکسید سولفور آزاد مورد حمله قرار میگیرد. تنها نقطه ذوب تنگستن و رنیم از این عنصر بیشتر است ( نقطه ذوب k 3290 و نقطه جوش k 5731).کاربردهــــــا
کاربرد اصلی تانتالم ، بصورت پودر فلزی در تولید قطعات الکترونیکی ، عمدتا" خازنهای تانتالم میباشد. موارد استفاده از خازنهای تانتالم ، بیشتر در تلفنهای سیار ، پیجرها ، رایانهها و الکترونیک موتوری است. از تانتالم همچنین جهت تولید آلیاژهای مختلفی که دارای نقاط ذوب بالا ، مقاومت و انعطاف پذیری هستند، استفاده میشود.تانتالم با عناصر دیگر آلیاژهایی میسازد که در تولید ابزارهای کاربید برای وسایل فلزکاری و در تولید ابر آلیاژها برای قطعات موتورهای جت ، ابزار فرآیندهای شیمیایی ، رآکتورهای هستهای و قطعات موشک بکار میروند. این فلز ، انعطافپذیر بوده و میتوان آنرا به شکل سیمهای ظریفی تبدیل نمود که بعنوان یک افروزه جهت تبخیر فلزاتی همچون آلومینیوم بکار میروند.
چون در برابر واکنش مایعات بدن مصون است و تحریک کننده نیز نمیباشد، در ساخت وسایل جراحی کاربرد وسیعی دارد. قرار است از اکسید تانتالم برای ساخت شیشههایی با ضریب شکست بالا جهت لنز دوربین استفاده شود. علاوه بر اینها از این فلز در تولید قسمتهای کوره خلأ استفاده میگردد.
ترکیبات
دانشمندان آزمایشگاه ملی Los Alamos ماده های مرکب گرافیت ، کاربید و تانتالم ساختهاند که یکی از سختترین مواد ساخته شده محسوب میشود.ایزوتوپهــــــا
تانتالم بطور طبیعی دارای دو ایزوتوپ میباشد، Ta-181 که ایزوتوپی پایدار است وTa-180 که ایزوتوپ رادیواکتیو است که خیلی سریع به یک ایزومر هستهای با نیم عمر بیش از 15 10 سال تبدیل میشود.هشدارهـــــــا
ترکیبات دارای تانتالم بهندرت مشکل ساز بوده و این فلز عموما" در آزمایشگاه دردسرساز نمیباشد. اما باید آنرا شدیدا" سمی به حساب آورد. شواهدی مبنی بر تومور زایی ترکیبات تانتالم وجود دارد و گرده فلز آن ، خطر انفجار و احتراق در پی دارد.
|
|||||||||||||||||||||||||||||||||||||
| عمومی | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| نام , علامت اختصاری , شماره | Tungsten, W, 74 | ||||||||||||||||||||||||||||||||||||
| گروه شیمیایی | فلز انتقالی | ||||||||||||||||||||||||||||||||||||
| گروه , تناوب , بلوک | 6 VIB, 6 , بلوک d | ||||||||||||||||||||||||||||||||||||
| جرم حجمی , سختی | 19250 kg/m3, 7.5 | ||||||||||||||||||||||||||||||||||||
| رنگ | سفید خاکستری درخشان |
||||||||||||||||||||||||||||||||||||
| خواص اتمی | |||||||||||||||||||||||||||||||||||||
| وزن اتمی | 183.84 amu | ||||||||||||||||||||||||||||||||||||
| شعاع اتمی(calc.) | 135 (193) pm | ||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | 146 pm | ||||||||||||||||||||||||||||||||||||
| شعاع وندروالس | اطلاعات موجود نیست | ||||||||||||||||||||||||||||||||||||
| ساختار الکترونی | Xe]4اوربیتال f14 5d4 6 s2] | ||||||||||||||||||||||||||||||||||||
| e- بازای هر سطح انرژی | 2, 8, 18, 32, 12, 2 | ||||||||||||||||||||||||||||||||||||
| درجه اکسیداسیون (اکسید) | 6, 5, 4, 3, 2 (اسید ملایم) | ||||||||||||||||||||||||||||||||||||
| ساختار کریستالی | مکعبی body centered | ||||||||||||||||||||||||||||||||||||
| خوااص فیزیکی | |||||||||||||||||||||||||||||||||||||
| حالت ماده | جامد | ||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 1 E3 K (6192 °F) | ||||||||||||||||||||||||||||||||||||
| نقطه جوش | 5828 K (10031 °F) | ||||||||||||||||||||||||||||||||||||
| حجم مولی | 9.47 scientific notation|ש10-6 m3/mol | ||||||||||||||||||||||||||||||||||||
| گرمای تبخیر | 824 kJ/mol | ||||||||||||||||||||||||||||||||||||
| گرمای همجوشی | 35.4 kJ/mol | ||||||||||||||||||||||||||||||||||||
| فشار بخار | 4.27 Pa at 3680 K | ||||||||||||||||||||||||||||||||||||
| سرعت صوت | 5174 m/s at 293.15 K | ||||||||||||||||||||||||||||||||||||
| متفرقه | |||||||||||||||||||||||||||||||||||||
| الکترونگاتیویته | 2.36 (درجه پائولینگ) | ||||||||||||||||||||||||||||||||||||
| ظرفیت گرمایی ویژه | 130 J/kg*K | ||||||||||||||||||||||||||||||||||||
| رسانائی الکتریکی | 18.9 106/m اهم | ||||||||||||||||||||||||||||||||||||
| رسانائی گرمایی | 174 W/m*K | ||||||||||||||||||||||||||||||||||||
| 1st پتانسیل یونیزاسیون | 770 kJ/mol | ||||||||||||||||||||||||||||||||||||
| 2nd پتانسیل یونیزاسیون | 1700 kJ/mol | ||||||||||||||||||||||||||||||||||||
| پایدارترین ایزوتوپها | |||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
| واحدهای SI & STP استفاده شده ، مگر آنکه ذکر شده باشد. | |||||||||||||||||||||||||||||||||||||
اطلاعات اولیه
تنگستن ( نام سابق آن wolfram ) ، عنصر شیمیایی است که در جدول تناوبی دارای نشان W و عدد اتمی 74 میباشد. تنگستن که عنصری است بسیار سخت و سنگین ، جزو فلزات انتقالی و به رنگ خاکستری مایل به آبی تا سفید در سنگهای معدنی بسیاری از جمله ولف رامیت و شیلیت یافت شده و از نظر خصوصیات فیزیکی نیرومند خود قابل توجه است. از نوع خالص آن بیشتر در مصارف الکتریکی استفاده میشود، اما ترکیبات و آلیاژهای فراوان آن کاربردهای بسیار زیادی دارد؛ ( بارزترین آنها افروزه های لامپ و آلیاژهای دیرگداز عصر فضا است).تاریخچـــــه
فرضیه وجود تنگستن ( واژه سوئدی tung sten به معنی سنگ سنگین ) برای اولین بار در سال 1779 توسط "Peter Woulfe" مطرح شد. او ولف رامیت را مورد بررسی قرار داد ( که بعدها نام آن از نام Woulfe گرفته شد ) و نتیجه گرفت که آن باید حاوی ماده جدیدی باشد. سال1781 "Carl Wilhelm Scheele" اثبات نمود که میتوان از تنگستنیت یک اسید جدید را تولید کرد. Scheele و Berman پیشنهاد کردند که احتمال تهیه یک فلز جدید بوسیله کاهش اسید تنگستنی وجـــــــود دارد."Fausto Elhuyar" برادرش وجود اسیدی را در ولف رانیت کشف کردند که مشابه اسید تنگستنی بود. بعدها در همان سال این دو برادر از طریق کاهش این اسید با ذغال چوب موفق به جداسازی تنگستن شدند. آنها با کشف این عنصر مورد قدردانی قرار گرفتند.
پیدایــــــش
تنگستن در سنگ معدن ولف رامیت ( تنگستن آهن – منگنز FeWO4/MnWO4 ) شیلیت (کلسیم تنگستن CaWO4) فربریت و huebnerite یافت میشود. ذخایر مهم این مواد در بولیوی ، کالیفرنیا ، چین ، کلرادو ، پرتقال ، روسیه و کره جنوبی واقع است ( تقریبا" 75% تنگستن مورد نیاز جهان را چین تولید میکند ). این فلز با روش کاهش اکسید تنگستن بوسیله هیدروژن یا کربن بصورت تجاری تولید میشود.خصوصیات قابل توجه
تنگستن خالص به رنگ خاکستری مایل به آبی تا فلز سخت سفید رنگ است. اگر خلوص آن زیاد باشد، میتوان آنرا با اره آهن برید ( اگر ناخالص باشد، شکننده و کار با آن دشوار است ). در غیر این صورت باید با آختن ، ورزیدن یا روزن رانی با آن کار کرد. این فلز در دمای بالای 1650 درجه سانتیگراد بالاترین نقطه ذوب ( 3422 درجه سانتیگراد ) پایینترین فشار بخار و بیشترین مقاوت کششی را در بین تمامی فلزات دارا میباشد. مقاومت آن در برابر فرسایش هم بسیار خوب است و فقط اسیدهای معدنی تاحدی آنرا تحت تاثیرقرار میدهند. فلز تنگستن اگر در معرض هوا قرار بگیرد، یک اکسید محافظی را تشکیل میدهد. اگر مقدار کمی از آن با فولاد آلیاز شود، استحکام آن را تا حد زیادی افزایش میدهد.کاربردهـــــا
تنگستن ، فلزی است که دامنه کاربردهای آن بسیار وسیع است؛ عمدهترین آنها کاربید تنگستن ( W2C , WC) در کاربیدهای سیمانی شده میباشد. کاربیدهای سیمانی شده ( نام دیگر آنها فلزات سخت است ) مواد پوششی مقاومی هستند که مورد استفاده صنایع فلزکاری ، استخراج معدن ، نفت و ساختمانی میباشند. چون تنگستن را میتوان بصورت رشته سیمهای بسیار باریک با نقطه ذوب زیاد در آورد، در افروزههای موجود در لامپ ، لامپ خلاء و الکترودها کاربرد زیادی دارد.سایر کاربردها
- نقطه ذوب زیاد تنگستن موجب شده در کاربردهای فضایی و مواردی مانند جوشکاری ، تفتیدن و کاربردهای الکتریکی که دما زیاد است، مورد استفاده قرار گیرد.
- استحکام و خصوصیات چگالی تنگستن آنرا برای ساخت آلیاژهای فلزسنگین که در تسلیحات ، گرماگیرها (heat sinks) و مصارف چگالی زیاد از قبیل وزنه و پارسنگها مناسب کرده است.
- فولاد بکار رفته در وسایل پر سرعت (Hastelloy , Stellite) اغلب با تنگستن آلیاژ شدهاند که این نوع فولاد حاوی 18% تنگستن میباشند.
- آلیاژهای دیرگداز که دارای این فلز هستند، در پوشش و قسمتهای تیغه توربین ، ابزار فولادی و آلیاژ پوششی مقاوم بکار میروند.
- آلیاژها بعنوان جایگزین سرب در گلوله مورد استفاده قرار میگیرند.
- ترکیبات شیمیایی تنگستن در کاتالیزورها ، رنگدانههای غیرآلی و روان کنندههای پر حرارت دیسولفید تنگستن که تا 500 درجه سانتیگراد مقاوم هستند، کاربرد دارند.
- چون انبساط حرارتی این عنصر شبیه شیشه بوروسیلیکات است، از آن در ساخت glass-to-metal seals بهره میبرند.
- اکسیدهای آن درلعاب کاری سرامیک کاربرد دارد.
- اسید تنگستیت منیزیم / کلسیم در لامپهای فلورسنت کاربرد زیادی دارند.
- از این فلز همچنین در اهداف اشعه X ، عناصر گدازنده برای کوره های الکتریکی استفاده میشود.
- نمکهای حاوی تنگستن در صنایع شیمیایی و دباغی بکار میروند.
- برنزهای تنگستن ( علت نام آنها رنگ اکسید تنگستن می باشد ) به همراه ترکیبات دیگر در رنگها کاربرد دارند.
نقش بیولوژیکی
آنزیمهایی که oxidoreductases نامیده میشوند، تنگستن را با همان روش بکارمیبرند که مولیبدنم در یک ترکیب تنگستن – پترین آنرا بکار میبرد.در 20 آگوست 2002 ، نمایندگان مراکز کنترل و جلوگیری از بیماریها وابسته به آمریکا اعلام کرد که آزمایشات ادرار روی خانواده های بیماران مبتلا به سرطان خون و خانوادههای گروه کنترل در منطقه Fallon , Nevada ، افزایش میزان تنگستن در بدن هردو گروه را نشان داده است. در منطقه Fallon 16 مورد آخر سرطان که در بچهها کشف شد، امروزه بعنوان زنجیره سرطان شناسایی شده است. "دکتر Carol H. Rubin" رئیس یکی از رشتههای پزشکی در CDC معتقد است در حال حاضر اطلاعات موجود ، ارتباط بین تنگستن و سرطان خون را تایید نمیکند.
 |
ترکیبات
رایجترین حالت اکسیداسیون تنگستن 6+ است. سایر حالات اکسیداسیون این عنصر عبارتند از 5+ ، 4+ ، 3+ ، 2+. اما تنگستن کلیه حالات اکسیداسیون از 2- تا 6 را بروز میدهد. تنگستن معمولا" با اکسیژن ترکیب شده و اکسید تنگستن زرد رنگی را بوجود میآورد ( WO3 ) که جهت تشکیل یونهای تنگستن در محلولهای قلیایی آبی حل میشود ( 2-WO4 ).محلولهای تنگستن دار آبی در شرایط خنثی و اسیدی ، برای تشکیل polyoxoanion مورد توجه هستند.
ایزوتوپهــــــــا
تنگستن بطور طبیعی از 5 رادیوایزوتوپ ساخته شده است که دارای چنان نیم عمرهای طولانی هستند که برای بیشتر اهداف پایدار به حساب میآیند. 27 رادیوایزوتوپ دیگر هم برای آن شناسایی شده است که پایدارترین آنها تنگستن 181 با نیمه عمر 2/121 روز ، تنگستن 185 با نیمه عمر 1/75 روز ، تنگستن 188 با نیمه عمر 69,4 روز و تنگستن 178 با نیمه عمر 21,6 روز میباشند. مابقی ایزوتوپهای رادیواکتیو ، دارای نیمه عمرهایی کمتر از 24 ساعت هستند که اکثر آنها نیز نیمه عمری کمتر از 8 دقیقه دارند. بعلاوه این عنصر از 4 حالت متا برخوردار است.ایزوتوپهای تنگستن از نظر وزن اتمیبین amu 157,974 (تنگستن 158) و amu 963,189 (تنگستن 190) ردیف شدهاند. حالت فروپاشی اولیه قبل از فراوانترین ایزوتوپ (تنگستن 184) جذب الکترون و حالت اولیه پس از آن فروپاشی بتا است. محصول فروپاشی اولیه قبل از تنگستن 184 ایزوتوپهای عنصر 73 ( تانتالم ) است و محصولات اولیه پس از آن ایزوتوپهای عنصر 75 ( رنیم ) میباشد.
|
|||||||||||||||||||||||||
| عمومی | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| نام, علامت اختصاری, شماره | Rhenium, Re, 75 | ||||||||||||||||||||||||
| گروه شیمیایی | فلز انتقالی | ||||||||||||||||||||||||
| گروه, تناوب, بلوک | 7 «VIIB), 6 , d | ||||||||||||||||||||||||
| جرم حجمی, سختی | 21020 kg/m3, 7 | ||||||||||||||||||||||||
| رنگ | سفید متمایل به خاکستری |
||||||||||||||||||||||||
| خواص اتمی | |||||||||||||||||||||||||
| وزن اتمی | 186.207 amu | ||||||||||||||||||||||||
| شعاع اتمی (calc.) | 135 (188) pm | ||||||||||||||||||||||||
| شعاع کووالانسی | 159 pm | ||||||||||||||||||||||||
| شعاع وندروالس | اطلاعات موجود نیست | ||||||||||||||||||||||||
| ساختار الکترونی | Xe]4f145d56s2] | ||||||||||||||||||||||||
| -e بازای هر سطح انرژی | 2, 8, 18, 32, 13, 2 | ||||||||||||||||||||||||
| درجه اکسیداسیون (اکسید) | 6, 4, 2, -2 (اسید ملایم) | ||||||||||||||||||||||||
| ساختار کریستالی | شش گوشه | ||||||||||||||||||||||||
| خواص فیزیکی | |||||||||||||||||||||||||
| حالت ماده | جامد | ||||||||||||||||||||||||
| نقطه ذوب | 3459 K (5767 °F) | ||||||||||||||||||||||||
| نقطه جوش | 5869 K (10105 °F) | ||||||||||||||||||||||||
| حجم مولی | 8.86 ((scientific notation|ש»10-6 m3/mol | ||||||||||||||||||||||||
| گرمای تبخیر | 715 kJ/mol | ||||||||||||||||||||||||
| گرمای هم جوشی | 33.2 kJ/mol | ||||||||||||||||||||||||
| فشار بخار | 3.24 Pa at 3453 K | ||||||||||||||||||||||||
| سرعت صوت | 4700 m/s at 293.15 K | ||||||||||||||||||||||||
| متفرقه | |||||||||||||||||||||||||
| الکترونگاتیویته | 1.9 (درجه پائولینگ) | ||||||||||||||||||||||||
| ظرفیت گرمایی ویژه | 137 J/kg*K | ||||||||||||||||||||||||
| رسانائی الکتریکی | 5.42 106/m اهم | ||||||||||||||||||||||||
| رسانائی گرمایی | 47.9 |W/m*K | ||||||||||||||||||||||||
| 1st پتانسیل یونیزاسیون | 760 kJ/mol | ||||||||||||||||||||||||
| 2nd پتانسیل یونیزاسیون | 1260 kJ/mol | ||||||||||||||||||||||||
| 3rd پتانسیل یونیزاسیون | 2510 kJ/mol | ||||||||||||||||||||||||
| 4th پتانسیل یونیزاسیون | 3640 kJ/mol | ||||||||||||||||||||||||
| پایدارترین ایزوتوپها | |||||||||||||||||||||||||
|
|||||||||||||||||||||||||
| واحدهای SI & STP استفاده شده ، مگر آنکه ذکر شده باشد. | |||||||||||||||||||||||||
اطلاعات اولیه
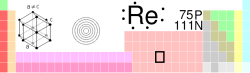
رنیوم ، یکی از عناصر شیمیایی جدول تناوبی است که نماد آن ، Re و عدد اتمی آن ، 75 میباشد. Rhenium یک فلز انتقالی و چند ظرفیتی است که رنگ نقرهای مایل به سفید داشته ، از فلزات سنگین و نادر است. این عنصر از نظر شیمیایی همانند منگنز بوده و در برخی آلیاژها بکار برده میشود. Rhenium بهصورت یک محصول جانبی در پالایش مولیبدنوم بدست میآید و آلیاژ Rhenium-Molybdenum یک ابر رسانا میباشد. این عنصر آخرین عنصری است که در طبیعت بوجود میآید.تاریخچه
Rhenium آخرین عنصر طبیعی بود که کشف شد. این عنصر در سال 1925 ، توسط "Wlater Noddack" و "Ida Tacke" و "Otto Berg" در آلمان کشف شد. آنها بیان کردند که توانستهاند عنصری را از پلاتین در معدن Columbite جدا کنند. آنها این عنصر را در Gadolinite و Molybdenite نیز یافتند. در سال 1928 آنها توانستند که یک گرم از این عنصر را از 660 کیلوگرم Molybdenite استخراج کنند.فرایند استخراج این عنصر بسیار پیچیده و پر هزینه بود و به همین دلیل تولید آن تا اوایل سال 1950 که آلیاژهای Tungsten-Rhenium و Molybdenum-Rhenium آماده شد، به تعویق افتاد. از آنجا که این آلیاژها کاربردهای زیادی در صنعت داشتند، تقاضا برای تولید Rhenium را از معادن سنگ Porphyry و مس در Molybdenite افزایش داد.
پیدایش
Rhenium بهصورت طبیعی و آزاد و یا حتی بهصورت ترکیبی با گونههای طبیعی در طبیعت یافت نمیشود. این عنصر به مقدار 0.001 ppm در پوسته کره زمین وجود دارد. این عنصر بهصورت تجاری از Molybdenum که در معادن سولفید مس وجود دارد، استخراج میشود. برخی معادن Molybdenum حدوداً %0.002 تا 02% Rhenium دارند. فلز این عنصر با کم کردن Ammonium perrhentate با هیدروژن در دمای بالا بدست میآید.خصوصیات قابل توجه
Rhenium ، یک فلز درخشان و سفید مایل به نقرهای است که بالاترین نقطه ذوب را در میان همه عناصر به جز تنگستن و کربن دارد. این عنصر همچنین بعد از عناصر پلاتین ، ایریدیوم و اوسمیوم بالاترین چگالی را داراست. حالتهای اکسیداسیون آن ، عبارتند از: -1،+1،+2،+3،+4،+5،+6،+7 که حالتهای +7،+6،+4،+2 و -1 از بقیه بیشتر است.حالت تجاری این عنصر بهصورت پودر است. این عنصر با انجام عمل فشار در خلاء یا هوای هیدروژنی محکم میشود. این فرایند ، شکل فشرده ای از این عنصر بوجود میآورد که 90% چگالی فلز را داراست. این فلز هنگام حرارت دادن بسیار رسانا شده ، بهراحتی خم شده ، به شکل مارپیچ و یا رول در میآید. آلیاژ Rhenium-Molybdenum بسیار رسانا (ابر رسانا) میباشند.
کاربردها
- این عنصر ، در ساخت کاتالیزور Platinum-Rhenium که در ساخت بنزین سوپر و بدون سرب کاربرد دارد ، بکار میرود.
- بهصورت آلیاژ سنگین که قطعات مختلف موتور هواپیما کاربرد دارد.
- بهصورت Filament در طیف سنج جرمی و اندازه گیرهای یونی استفاده می شود.
- بهعنوان ماده اضافه شونده به تنگستن و آلیاژهای مولیبدنی برای دادن خواص مفید به آنها استفاده میشود.
- کاتالیزورهای Rhenium در مقابل واکنشهای شیمیایی بسیار مقاوم بوده ، در واکنشهای هیدروژنی استفاده میشوند.
- با توجه به خاصیت پایداری و خورده نشدنی ، بهعنوان ماده مخصوص برای اتصالات الکترونیکی استفاده میشود.
- از ترموکوپلهایی که آلیاژ Rhenium و Tungsten دارند برای اندازه گیری دماهای بالا تا 2200 درجه سانتیگراد استفاده میشود.
- از سیم Rhenium در ساخت لامپهای فلاش دوربینهای عکاسی استفاده میشود.
ایزوتوپها
Rhenmium که بهصورت طبیعی بوجود می آید یک ایزوتوپ پایدار و یک ایزوتوپ رادیواکتیوی دارد که از نیم عمر بالایی برخوردار است. برای این عنصر 26 ایزوتوپ ناپایدار دیگر شناخته شده است.هشدارها
در خصوص سمی بودن Rhenium اطلاعات کمی وجود دارد. از این رو بهتر است که با این عنصر با احتیاط کار شود.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
اطلاعات اولیه
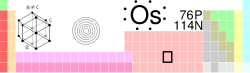
اوسمیوم ، یکی از عناصر شیمیایی جدول تناوبی است که نماد آن Os و عدد اتمی آن 76 میباشد. یک فلز انتقالی سخت و شکننده به رنگ آبی متمایل به خاکستری یا آبی مایل به سیاه از خانواده پلاتین میباشد. اوسمیوم اگر سخترین فلز نباشد یکی از سخترین فلزهاست که در بعضی آلیاژها همراه پلاتین و ایریدیوم استفاده میشود. اوسمیوم به صورت غیرترکیبی به صورت آلیاژ در سنگ معدن پلاتین یافت میشود و تترواکسید آن برای رنگی کردن بافتها ( در آزمایشگاهها ) و در انگشت نگاری استفاده میشود. آلیاژهای اوسمیوم در نوک خودکارهای ساچمهای و نقاط تماس الکتریکی و مواردی که نیاز به دوام و سختی بالایی دارند، استفاده میشود.تاریخچه
اوسمیوم که یونانی آن osme به معنی رایحه میباشد. در سال 1803 توسط "Smithson Tennant" در لندن به همراه ایریدیوم در کنار عمل حل پلاتین در تیزاب سلطانی ( Aqua Regia ) کشف شد.پیدایش
این فلز انتقالی به صورت طبیعی در iridiosmium یک آلیاژ طبیعی ایریدیوم و اوسمیوم و در خاکهای رودخانه مملو از پلاتین ، در کوهای اورال و آمریکای شمالی و جنوبی یافت میشود. این فلز همچنین در سنگ معدنهای نیکل دار ، در منطقه Sudbury , Ontario به همراه دیگر فلزات گروه پلاتین یافت میشود. اگر چه فلزات پلاتین در این معادن کم است، حجم بالای سنگ معدن نیکل فراوری شده ، بازیافت این فلز را نظر اقتصادی با صرفه میسازد.خصوصیات قابل توجه
اوسمیوم به شکل فلز بوده و درخشان در دمای بالا میباشد. این فلز بسیار شکننده بوده ، با چگالی بسیار زیاد به رنگهای آبی و سفید میباشد. اما ساخت این فلز به صورت غیر طبیعی بینهایت دشوار میباشد. ساختن پودر اوسمیوم سادهتر میباشد، ولی پودر اوسمیوم وقتی در معرض هوا قرار بگیرد، تترواکسید اوسمیوم ( OsO4) را که ماده ای بسیار سمی است، شکل میدهد. اکسید آن همچنین یک ماده اکسید کننده قوی بوده و بوی شدیدی دارد و در دمای 130 درجه سلسیوس به جوش میآید.اوسمیوم به خاطر چگالی بالای آن معمولا به عنوان سخترین فلز که حتی از ایریدیوم هم سختتر است، شناخته میشود. البته محاسبات در شبکه فضایی از محاسبات معمولی که چگالی kg/m3 22650 را به ایریدیوم و kg/m3 22661 را به اوسمیوم اختصاص میدهد، دقیقتر بوده و نتایج مورد اطمینانتری را ارائه میدهد. بنابراین در حال حاظر نمیتوان یک مرز مشخصی را از نظر چگالی برای اوسمیوم و ایریدیوم قائل شد، چرا که آنها کاملا به هم نزدیک هستند.
این فلز در میان خانواده پلاتین بیشترین دمای ذوب و پایینترین فشار بخار را داراست. حالتهای اکسیداسیون معمولی اوسمیوم +4 و +3 میباشد، ولی حالتهای اکسیداسیون +1 تا +8 نیز مشاهده شده است.
کاربردها
از آنجا که اکسید این فلز بینهایت سمی میباشد، بهندرت بهصورت خالص از آن استفاده میشود و اغلب به صورت آلیاژ با دیگر فلزات در مواردی که نیاز به دوام بالا دارند، کاربرد دارد. آلیاژ اوسمیوم به همراه دیگر فلزات پلاتین بسیار سخت بوده و در مواردی که نیاز به آلیاژهای سخت دارند، مانند نوک خودکار ، سوزنهای گرامافون ، لوله ، محور ابزار ، لوازم گوناگون و اتصالات الکترونیک کاربرد دارد.تترو اکسید اوسمیوم برای تشخیص اثرانگشت و رنگ کردن بافتهای چرب برای اسلایدهای میکروسکپی کاربرد دارد. آلیاژ 90% پلاتین و 10% اوسمیوم در کاشتهای جراحی مانند ضربان ساز و جایگزینی دریچه های ریوی استفاده میشود.
ترکیبات
تتروکسید اوسمیوم OsO4 ، از ترکیبات آن میباشد.ایزوتوپها
اوسمیوم هفت ایزوتوپ طبیعی دارد که پنج تا از آنها پایدارند: Os-187، Os-188، Os-189، Os-190 و Os-192 که فراوان ترین آنها میباشد. Os-184 , Os-186 نیمه عمر زیادی داشته و برای اهداف کاربردی میتوان آنها را ایزوتوپ پایدار در نظر گرفت. Os-187 دخترخوانده Rhenium -187 بوده که نیمه عمر آن 4.56 x 1010 میباشد و اغلب با نسبت Os-187/Os-186 اندازه گیری میشود. این نسبت ، همانند نسبت Re-187/Os-187 که همانند شهاب سنگ برای تعیین عمر زمین استفاده میشود. به هر حال مهمترین کاربرد قابل توجه اوسمیوم در تعیین تاریخ در ترکیب با ایریدیوم ، برای تجزیه و تحلیل لایههای کوارتز صدمه دیده ( Shocked Quartz ) در طول K-T boundary که به انقراض دایناسورها در 65 میلیون سال پیش انجامید، میباشد.هشدارها
تتروکسید اوسمیوم بسیار سمی است. غبار اوسمیوم در هوا حتی به میزان کم 7-10 گرم بر متر مکعب باعث گرفتگی ریه و آسیب به پوست و چشم میشود.
|
|||||||||||||||||||||||||
| عمومی | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| نام , علامت اختصاری , شماره | Iridium, Ir, 77 | ||||||||||||||||||||||||
| گروه شیمیایی | فلز انتقالی | ||||||||||||||||||||||||
| گروه , تناوب , بلوک | 9 , 6 , d | ||||||||||||||||||||||||
| جرم حجمی, سختی | 22650 kg/m3 , 6.5 | ||||||||||||||||||||||||
| رنگ | سفید نقرهای |
||||||||||||||||||||||||
| خواص اتمی | |||||||||||||||||||||||||
| وزن اتمی | 192.217 amu | ||||||||||||||||||||||||
| شعاع اتمی (calc.) | 135 (180) pm | ||||||||||||||||||||||||
| شعاع کووالانسی | 137 pm | ||||||||||||||||||||||||
| شعاع وندروالس | اطلاعات موجود نیست | ||||||||||||||||||||||||
| ساختار الکترونی | Xe]4f14 5d7 6s2] | ||||||||||||||||||||||||
| e- بازای هر سطح انرژی | 2, 8, 18, 32, 15, 2 | ||||||||||||||||||||||||
| درجه اکسیداسیون (اکسید) | 2, 3, 4, 6 (باز ضعیف) | ||||||||||||||||||||||||
| ساختار کریستالی | صورت مکعبی centered | ||||||||||||||||||||||||
| خواص فیزیکی | |||||||||||||||||||||||||
| حالت ماده | جامد __) | ||||||||||||||||||||||||
| نقطه ذوب | 2739 K (4471 °F) | ||||||||||||||||||||||||
| نقطه جوش | 4701 K (8002 °F) | ||||||||||||||||||||||||
| حجم مولی | 8.52 ((scientific notation|ש»10-6 m3/mol | ||||||||||||||||||||||||
| گرمای تبخیر | 604 kJ/mol | ||||||||||||||||||||||||
| گرمای همجوشی | 26.1 kJ/mol | ||||||||||||||||||||||||
| فشار بخار | 1.47 Pa at 2716 K | ||||||||||||||||||||||||
| سرعت صوت | 4825 m/s at 293.15 K | ||||||||||||||||||||||||
| متفرقه | |||||||||||||||||||||||||
| الکترونگاتیویته | 2.20 (درجه پائولینگ) | ||||||||||||||||||||||||
| ظرفیت گرمایی ویژه | 130 J/kg*K | ||||||||||||||||||||||||
| رسانائی الکتریکی | 19.7 106/m اهم | ||||||||||||||||||||||||
| رسانائی گرمایی | 147 W/m*K | ||||||||||||||||||||||||
| 1st پتانسیل یونیزاسیون | 880 kJ/mol | ||||||||||||||||||||||||
| 2nd پتانسیل یونیزاسیون | 1600 kJ/mol | ||||||||||||||||||||||||
| پایدارترین ایزوتوپها | |||||||||||||||||||||||||
|
|||||||||||||||||||||||||
| SI واحدهای & STP استفاده شده مگر آنکه ذکر شده باشد. | |||||||||||||||||||||||||
اطلاعات اولیه
ایریدیم یکی از عناصر شیمیایی جدول تناوبی است که دارای نشان Ir و عدد اتمی 77 میباشد. ایریدیم عنصری سنگین ، بسیار سخت ، شکننده و فلز واسطه سفید رنگ از خانواده پلاتین میباشد که در آلیاژهای بسیار محکم که تحمل حرارتهای بالا را دارد، بکار میرود. این عنصر در آلیاژهای طبیعی با پلاتین و اسمیم وجود دارد.ایریدیم چون مقاومترین عنصر در برابر فرسایش بوده ، نیز بهعلت ارتباط آن با انقراض دایناسورها از اهمیت خاصی برخوردار است. این عنصر در دستگاههای پُرحرارت ، اتصالات برقی و بعنوان عامل سختکننده برای پلاتین مورد استفاده قرار میگیرد.
تاریخچــــــــه
ایریدیم را ( واژه لاتین iris به معنی رنگین کمان ) "Smithson Tennant" سال 1803 در لندن به همراه اسمیم در پسمانده تیره رنگ پلاتین خام محلول در تیزاب سلطانی ( مخلوط هیدروکلریک و اسید نیتریک کشف نمود. نام این عنصر از نام لاتین واژه رنگینکمان اقتباس شده ، چون نمکهای آن بسیار رنگارنگ هستند.بنا بود در پاریس میله متر استاندارد از این فلز ساخته شود که آلیاژی 90% پلاتین و 10% ایریدیم است. در سال 1960 ، نوار اندازهگیری پاریس ، جایگزین تعریف واحد پایه درازا شد؛ ( به کریپتون مراجعه کنید ). حادثه KT ( انقراض دوران سوم و کرتاسه ) که مرز زمانی بین دوران کرتاسه و دوران سوم زمین شناسی را مشخص میکند، بوسیله لایه نازک ایریدیم شناسایی شد.
به عقیده بسیاری از دانشمندان از جمله Luis Alvarez از برکلی کالیفرنیا ، این ایریدیم منشاء فرا زمینی دارد و به یک اخترچه یا ستاره دنبالهدار منتسب میشود که احتمالا" نزدیک جایی که امروزه شبه جزیره یوکاتان نامیده میشود، سقوط کرده است. با اینهمه دانشمندان دیگری از جمله M. McLean از موسسه پلی تکنیک ویرجینیا معتقدند که ایریدیم منشا آتشفشانی دارد. هسته زمین غنی از اریدیم میباشد و بعنوان مثال Piton de la Fournaise در R鵮ion امروزه همچنان ایریدیم آزاد میکند.
پیدایــــــــــش
ایریدیم در طبیعت بصورت غیر ترکیب با پلاتین و سایر فلزات گروه پلاتین در ذخائر آبرفتی یافت میشود. آلیاژهای طبیعی این عنصر شامل Osmiridium و Iridiosmium است که هر دوی آنها مخلوطی از ایریدیم و اسمیم میباشند. ایریدیم بصورت تجاری بعنوان محصول فرعی از استخراج و پردازش نیکل بازیافت میشود.خصوصیات قابل توجه
ایریدیم که فلزی از خانواده پلاتین میباشد، مانند پلاتین سفید رنگ است، اما اثری از زرد کم رنگ در آن وجود دارد. بهسبب سختی و شکنندگی بسیار زیاد این عنصر ، برش ، شکل دادن و کار با آن دشوار است. ایریدیم مقاومترین فلز شناخته شده در مقابل فرسایش بهحساب میآید.ایریدیم تحت تاثیر هیچ اسید یا تیزاب سلطانی ( آمیزه ای از اسید نیتریک و اسید هیدروکلریک ) قرار نمیگیرد، ولی مورد حمله نمکهای مذاب مثل NaCl و NaCN قرار میگیرد. چگالی این عنصر تنها کمی از اسمیم که سنگینترین عنصر شناخته شده بهحساب میآید، کمتر است. بنابراین احتمالا" محاسبه چگالی از روی شبکه فضائی ، نسبت به اندازه گیری واقعی ، اطلاعات دقیقتری در مورد این عناصر ارائه میکند و چگالی 22650 را برای ایریدیم در مقابل 22661 برای اسمیم تعیین میکند. لذا انتخاب قطعی بین این دو در حال حاضر ممکن نمیباشد. ولی دستیابی به آن بسیار نزدیک است.
کاربردهـــــــــا
- اصلیترین مورد استفاده اریدیم بعنوان عامل سختکننده در آلیاژهای پلاتین است.
- برای ساخت دیگ کوره و وسایلی که به دمای بالا نیاز دارند.
- اتصالات برقی ( بارزترین نمونه آنها شمعهای اتومبیل Pt/Lr است. )
- آلیاژهای اسمیم/ایریدیم در نوک خودکارها و قطب نماها مورد استفاده قرار میگیرند.
- زمانی ایریدیم بصورت آلیاژ با پلاتین در سوراخهای مخزن توپهای سنگین و به حالت پودری ( ایریدیم سیاه ) برای سیاه رنگ کردن(چینی بکار میرفت.
ایزوتوپهـــــــا
ایریدیم دارای ایزوتوپهایطبیعی و تعداد زیادی رادیوایزوتوپ میباشد که پایدارترین آنها Ir-192 دارای نیمه عمر 73,83 روز است. Ir-192 بصورت پلاتین متلاشی میشود، در صورتیکه بیشتر رادیوایزوتوپهای دیگر به شکل اسمیـــم فروپـاش میشوند.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
اطلاعات اولیه
پلاتین ، یکی از عناصر شیمیایی جدول تناوبی است که علامت آن Pt بوده و عدد اتمی آن 78 میباشد. پلاتین یک فلز انتقالی خاکستری مایل به سفید که هادی جریان الکتریسیته بوده ، قابل انعطاف ، سنگین و بسیار باارزش است بوده و در مقابل خورده شدن و اکسیداسیون مقاوم بوده و در برخی از معادن مس و نیکل یافت میشود. از پلاتین در جواهرات , تجهیزات آزمایشگاهی ، اتصالات الکتریکی ، دندانپزشکی و دستگاه ضد آلودگی در اتومبیل استفاده میشود.تاریخچه
پلاتین از واژه اسپانیولی Platina که به معنی نقره کوچک میباشد، گرفته شده است. سالهای زیادی است که پلاتین طبیعی و پلاتین غنی شده آلیاژی شناخته شده است. این فلز توسط سرخپوستهای کلمبیایی استفاده میشده است و اولین مرجع اروپایی به پلاتین در سال 1557 در نوشتههای انسانشناس ایتالیایی " Julius Caesar Scaliger" دیده میشود که از آن ، بهعنوان یک فلز اسرار آمیز که از معادن آمریکای مرکزی بین Darién ( پاناما ) و مکزیک استخراج شده و نیز گفته شده است: "تا کنون حتی با هنرهای اسپانیایی ها هم غیر قابل ذوب است." |
اسپانیائیها این فلز را وقتی اولین بار وارد اسپانیا شدند Platina نامیدند. آنها به آن ، به چشم یک ناخالصی در نقره ای که استخراج میکردند نگاه میکردند و اغلب از آن صرف نظر میکردند.
پلاتین توسط "Antonio De Ulloa" ستاره شناس و "Don Jorge Juan y Santacilia" کشف شد. هر دوی آنها توسط پادشاه فیلیپ پنجم برای پیوستن به یک ماموریت جغرافیائی در پرو که از 1735 تا 1745 طول کشید، دعوت شدند. در میان چیزهای دیگر در کلمبیا اولوا ، Platina del pinto را مشاهده کرد که فلزی بیاستفاده بود که به همراه طلا در New Granada (کلمبیا) پیدا شده بود.
privateerهای انگلیسی کشتی اولوا را در سفر بازگشت توقیف کردند. اگر چه در انگلستان با او خوش رفتاری شد و حتی در انجمن سلطنتی عضو شد، تا سال 1748 از انتشار یافتههایش در مورد فلز ناشناخته منع شد. قبل از آن در سال 1741 ، "Charles Wood" مسقلا این عنصر را جدا کرده بود.
پلاتین در حال حاضر با ارزشتر و گرانتر از طلا میباشد و از این جهت جایزههای پلاتینی بهتر از جایزههای طلایی میباشند. قیمت پلاتین بسته به فراوانیش تغییر میکند، ولی معمولا 8 برابر طلا ارزش دارد. برای مدتهای طولانی تعریف استاندارد متر بر اساس فاصله بین دو علامت بر روی شمش پلاتین-ایریدیوم بود که در سور ( Sevres )نگهداری میشد، تعیین شده بود. از این فلز همچنین در تعریف "Standard Hydrogen Electrode" نیز استفاده میشود.
پیدایش
پلاتین معمولا به حالت خالص و یا در سنگ معدن اسپریلیت ( آرسنید پلاتین PtAs2 ) که بزرگترین منبع این فلز است، یافت میشود. آلیاژ طبیعی پلاتین و ایریدیوم Platiniridium بوده که در Cooprite معدنی ( سولفید پلاتین، Pt S ) یافت میشود. |
این فلز معمولا با مقدار کمی از دیگر فلزات خانواده پلاتین که در مواد آبرفتی در کلمبیا ، اونتاریو و کوههای اورال و در برخی از ایالتهای غربی آمریکا یافت میشوند، همراه است.
پلاتین از نظر اقتصادی بهعنوان محصول جانبی فراوری سنگ معدن نیکل تولید میشود. حجم عظیم سنگ معدن فرآوری شده نیکل ، نشانگر این است که پلاتین تنها 2 در میلیون از این سنگ معدن میباشد.
خصوصیات قابل توجه
این فلز در هنگامی که خالص باشد، بسیار زیبا و به رنگ نقرهای مایل به سفید بوده ، هادی جریان الکتریسیته و نرم و قابل انعطاف میباشد. این فلز در برابر خوردگی مقام است. ویژگیهای کاتالیزوری فلزات گروه ششم از خانواده پلاتین بسیار برجسته و مهم میباشد. ( توجه داشته باشید که هیدروژن و اکسیژن در مجاورت پلاتین منفجر میشوند). دوام بالا و خاصیت ضد تیرگی پلاتین دلیل استفاده از این فلز در ساخت جواهرات ظریف و زیبا میباشد.دیگر ویژگیهای ممتاز این فلز ، پایداری در برابر واکنشهای شیمیایی و دماهای بالا و خاصیت پایدار الکتریکی میباشد. از تمامی این ویژگیها در صنعت استفاده میشود. پلاتین در مجوارت با هوا در هیچ درجه ای اکسید نمیشود، اما توسط سیانیدها ، هالوژنها ، گوگرد و بازهای قوی خورده میشود. این فلز در اسید هیدروکلریک و اسید نیتریک حل نمیشود، ولی بهراحتی در محلول تیزاب سلطانی حل میشود ( اسید کلروپلاتینیک را به وجود میآورد ). حالتهای اکسیداسیون پلاتین +2،+3 و +4 میباشند.
کاربردها
،از پلاتین در جواهرات ، سیم ، ساخت ظروف با تحمل حرارتی بالا برای مصارف شمیایی و کورههای برقی حرارت بالا استفاده میشود.- از پلاتین خوب جدا شده به عنوان کاتالیزور استفاده میشود. برای مثال در مبدلهای کاتالیزوری خودروها و فرایندهای صنعتی مختلف مانند ساخت اسید سولفوریک استفاده میشود.
- این فلز میتواند مقدار زیادی از گاز هیدروژن را جذب کرده ، هنگامی که حرارت داده میشود، آن را آزاد کند. از این جهت بهعنوان منبع ذخیره گاز در وسایل نقلیه و در سلول سوختی مطالعه میشود.
- صنایع شمیایی از مقدار قابل توجهی پلاتین یا آلیاژ پلاتین- رادیوم بهعنوان کاتالیزور و به شکل توری ریزبافت برای کاتالیز کردن اکیسیداسیون انتخابی آمونیاک برای تهیه اکسید نیتریک که ماده خام برای کودها و مواد منفجره میباشد و اسید نیتریک استفاده میکنند.
- پلاتینهای کاتالیزوری در تصفیه نفت خام و بهسازی فرایند تولید بنزین اکتان بالا و همچنین ترکیبات معطر در صنعت پتروشیمی کاربرد دارند.
- ضریب انبساط این فلز برابر با شیشههای Soda-Lime-Silica بوده و در ساخت الکترودهای آببندی شده در سیستمهای شیشهای کاربرد دارد.
- آلیاژ پلاتین و کبالت ، خاصیت مغناطیسی عالی دارد. آلیاژی که از 76% پلاتین و 23% کبالت تشکیل شده باشد، از نظر مغناطیسی بسیار قوی میباشد.
- آلیاژ 10/90 پلاتین/اوسمیوم برای ساخت ضربان ساز قلب ، دریچههای جایگزین و سایر کاشههای جراحی استفاده میشود.
- این فلز در پوشش کلاهکهای دماغه موشکها و نازل سوخت موتور جت و دیگر وسایلی که میبایست با ضریب اطمینان بالایی در حرارتهای بالا و در تناوبهای زمان طولانی کار کنند، کاربرد دارد.
- سیمهای پلاتینی ، وقتی در معرض متیل الکل قرار میگیرند، با رنگ قرمز تیره میدرخشند، درست همانند کاتالیزوری که الکل را به فرمالدئید تبدیل میکند. این پدیده بهصورت تجاری در ساخت فندک سیگار و دستگرمکنها استفاده میشود.
- Cis-platin با فرمول PtCl2(NH3)2 ، دارویی است که در درمان انواع خاصی از سرطانها که شامل سرطان خون (Lukemia) و سرطان بیضه میشود، کاربرد دارد.










 عناصر واسطه را بيشتر بشناسيم
عناصر واسطه را بيشتر بشناسيم